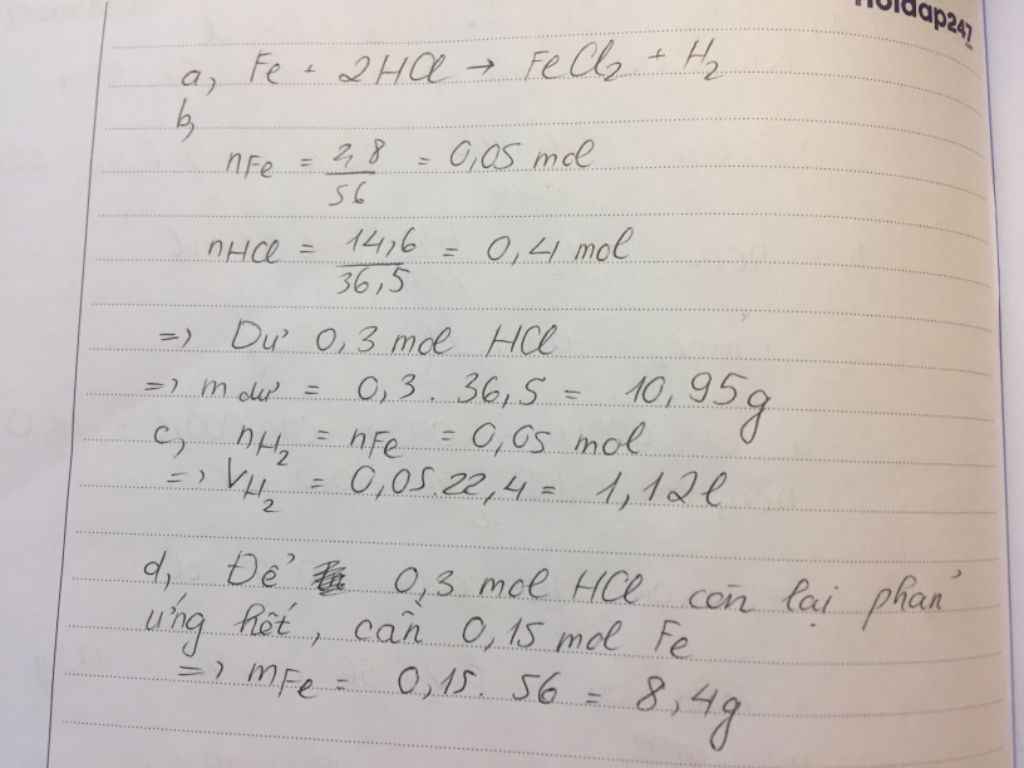1.Cho 3,6 g Magie tác dụng với dung dịch loãng chứa 18,25 g axit clohidric (HCl).
a. viết phương trình phản ứng xảy ra
b. Chất nào còn dư sau phản ứng, dư bao nhiêu gam?
c. Tính thể tích hiđro thu được ở đktc?
2.
Đốt cháy hoàn toàn 6,2 gam photpho trong không khí tạo thành điphotpho pentaoxit.
a. Viết phương trình phản ứng.
b. Tính thể tích khí oxi phản ứng (đktc).
c Tính khối lượng điphotpho pentaoxit tạo thành.
d. Tính thể tích không khí cần dùng để đốt cháy.